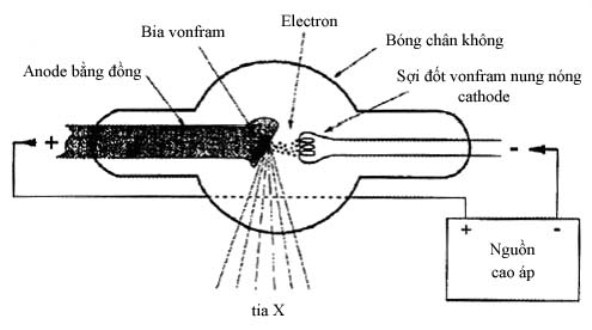
Nguyên lý và các phép đo quang sử dụng trong xét nghiệm sinh hoá.
I. NGUYÊN LÝ:
1.1. Bản chất của ánh sáng:
– Ánh sáng là một dạng vật chất vừa có tính chất hạt, vừa có tính chất sóng.
– Dựa vào tính chất sóng người ta giải thích được các hiện tượng giao thoa, nhiễu xạ và phân cực của ánh sáng.
– Dựa vào tính chất hạt của ánh sáng người ta giải thích được hiện tượng quang điện, quang hoá và hiện tượng hấp thụ ánh sáng. Ánh sáng được truyền đi trong không gian dưới dạng các hạt photon mang năng lượng còn gọi là quang tử.

1.2. Sự chuyển động phân tử và các mức năng lượng của phân tử vật chất:
– Cấu tạo phân tử của vật chất phức tạp hơn nhiều so với cấu tạo nguyên tử vì vậy chuyển động phân tử cũng rất phức tạp. Chuyển động của phân tử vật chất bao gồm chuyển động của các nguyên tử, chuyển động dao động và chuyển động quay của bản thân phân tử.
+ Chuyển động của các điện tử trong phân tử tạo thành đám mây điện tử.
+ Chuyển động dao động là sự thay đổi tuần hoàn vị trí tương đối của các hạt nhân nguyên tử trong phân tử.
+ Chuyển động quay của phân tử là sự thay đổi tuần hoàn sự định hướng của phân tử trong không gian. Các dạng chuyển động phân tử xảy ra đồng thời và có tương tác lẫn nhau. Mỗi dạng chuyển động phân tử đều có năng lượng đặc trưng. Năng lượng của phân tử gồm 3 dạng năng lượng: năng lượng điện tử, năng lượng dao động và năng lượng
quay.
1.3. Sự tương tác giữa ánh sáng và các phân tử vật chất ( Nguyên lý đo quang ):
– Nguyên lý đo quang: Dựa trên nguyên lý của hiện tượng quang phổ hấp thụ:
+ Quang phổ hấp thụ thực chất là quá trình tương tác giữa hạt photon của ánh sáng với các phần vật chất. Khi ta chiếu một chùm tia sáng gồm các photon có các mức năng lượng khác nhau đi qua một dung dịch chất hấp thụ. Dung dịch chỉ hấp thụ chọn lọc những photon nào có mức năng lượng phù hợp với các mức năng lượng điện tử, năng lượng dao động và năng lượng quay của phân tử chất đó.
– Như vậy các phân tử vật chất có cấu trúc khác nhau sẽ cho những phổ hấp thụ với các đỉnh và bước sóng đặc trưng khác nhau.
1.4. Các định luật về sự hấp thụ ánh sáng:
– Định luật Bouger – Lamber: cường độ của một chùm tia sáng đơn sắc khi đi qua một dung dịch chất hấp thụ tỷ lệ nghịch với chiều dày của lớp dung dịch mà nó đi qua.
– Định luật Beer: sự giảm cường độ ánh sáng khi đi qua một dung dịch chất hấp thụ phụ thuộc vào số lượng các tiểu phân tử vật chất hấp thụ mà ánh sáng gặp phải trên đường đi, nghĩa là phụ thuộc vào nồng độ của dung dịch chất hấp thụ.
– Theo định luật Bouguer – Lamber – Beer chỉ đúng với trường hợp chất cần xác định nồng độ là dung dịch loãng: Độ hấp thụ quang (mật độ quang học) tỷ lệ thuận với nồng độ dung dịch:
OD = A = εLC
*Trong đó:
OD hay E, A : Mật độ quang học của dung dịch.
C : Nồng độ dung dịch.
ε: Hệ số tắt của dụng dịch.
L : Chiều dày lớp dung dịch mà chùm tia sáng đi qua.
Trong các tham số trên, hệ số tắt của dung dịch không đổi, chiều dày lớp dung dịch mà chùm tia sáng đi qua không đổi. Bản chất dung dịch và bước sóng không đổi, nên mật độ quang OD chỉ còn phụ thuộc vào nồng độ C của dung dịch.
– Nếu nồng độ dung dịch cần định lượng vượt quá giới hạn cho phép thì mật độ quang học không còn tuyến tính với nồng độ dung dịch nữa. Khi đó nồng độ dung dịch tăng, khoảng cách giữa các phân tử là đáng kể, sẽ sai khác đi, hệ số hấp thụ không phụ thuộc tuyến tính vào nồng độ nữa, khi ấy phải pha loãng dung dịch, kết quả thu được phải nhân với tỉ lệ pha loãng.
– Quá trình dẫn truyền ánh sáng qua dung dịch được biểu diễn như sau:
I = I 10
(Mật độ quang OD chính là hiệu số giữa cường độ ánh sáng tia ló với cường độ ánh sáng tia tới khi đi qua dung dịch ).
OD= I – I
– Dựa vào định luật Bouguer – Lamber – Beer ta tính được nồng độ dung dịch cần đo:
Trong đó C là nồng độ dung dịch mẫu đã biết trước. OD (A ) mẫu là mật độ quang của dung dịch mẫu đo được. Như vậy hệ số K được coi là hệ số chuẩn trong quá trình làm xét nghiệm tìm nồng độ chất thử:
C = Hệ số K × OD = Hệ số K × A
Trong đó:
C : nồng độ mẫu thử.
OD hay A : mật độ quang của mẫu thử.
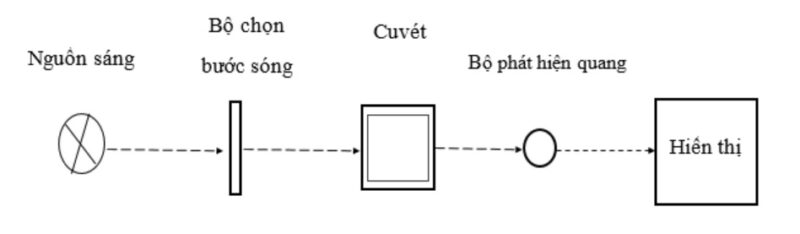
II. CÁC PHÉP ĐO QUANG (Method):
2.1. Phép đo điểm cuối (End point):
– Là phép đo mật độ quang (OD, A) của dung dịch chất thử mà trong quá trình thực hiện phản ứng xảy ra hoàn toàn sau một thời gian nhất định. Tại thời điểm đó phản ứng kết thúc và tạo ra phức hợp màu đặc trưng và bền vững.
– Mật độ đo được tỷ lệ thuận với nồng độ :
C = (A /A ).C = A .K
K: hệ số factor.
*Chú ý trong phép đo điểm cuối:
Trong hóa sinh lâm sàng, tất cả các xét nghiệm có phản ứng tạo mẫu đặc trưng, việc chọn bước sóng (kính lọc) phù hợp là việc làm bắt buộc. Hiện nay, hầu hết các xét nghiệm hóa sinh hiện đại, người ta sử dụng các loại thuốc thử với chế phẩm enzyme, sản phẩm của phản ứng màu thường được thể hiện dưới dạng màu hồng cánh sen thích hợp cho việc chọn kính lọc có bưước sóng 500 – 546 nm hoặc dưới dạng phức hợp màu xanh lục thích hợp cho việc lựa chọn kính lọc có bước sóng 578 – 620 nm.
– Các xét nghiệm hóa sinh: định lượng Glucose, protein, Albumin, Cholesterol, Triglycerid, HDL_c, LDL_c, Ure ( so màu ), Bilirubin…
2.2. Phép đo động học 2 điểm ( Two point kinetic, fixed time ):
– Phép đo này sử dụng cho các xét nghiệm hóa sinh có phản ứng xảy ra không hoàn toàn sau một thời gian nhất định. Không thể xác định điểm kết thúc của phản ứng.
+Tại thời điểm t1 , đo mật độ quang A1.
+Tại thời điểm t2 , đo mật độ quang A2.
∆A = A2 – A1: Hiệu số mật độ quang.
Nồng độ chất cần tìm được xác định theo công thức sau:
C = (A /A ).C = ∆A .K
Trong hóa sinh lâm sàng, xét nghiệm Ure và Creatinin máu thường được sử dụng phép đo động học 2 điểm.
2.3. Phép đo động học enzyme ( enzymatic kinetic ):
– Phép đo này sử dụng cho các xét nghiệm hóa sinh tìm hoạt độ các enzyme trong huyết thanh.
– Phản ứng enzyme thường không tạo phức hợp màu mà làm thay đổi độ đục của dung dịch phản ứng trong khoảng thời gian nhất định. Việc xác định hoạt độ của enzyme không thể xác định bằng phép đo điểm cuối mà phải sử dụng phép đo động học ở nhiều thời điểm ( t1, t2, t3, …, tn ).
– Người ta thường quen gọi đó là phép đo Kinetic.
– Phép đo này tính hoạt độ enzyme phải thông qua việc xác định hiệu số mật độ quang trung bình.
– Lấy hiệu số mật độ quang giữa hai thời điểm.
∆A1 = A2 – A1
∆A2 = A3 – A2
∆A3 = A4 – A3
∆A4 = A5 – A4
– Tính trung bình mật độ quang giữa các thời điểm.
∆A = (∆A1 + ∆A2 + ∆A3 + ∆A4)/4
C = ∆A.K
( K là hệ số factor do hãng sản xuất hoá chất xét nghiệm cung cấp ).
– Chú ý lắc đều, đo ngay.
– Các xét nghiệm: GOT, GPT, Amylase…
III. Ứng dụng:
– Đo nồng độ các chất có màu hay có thể cho phản ứng màu.
– Các giai đoạn của phương pháp đo màu:
+Thực hiện một dung dịch có màu chứa một chất cần định lượng với nồng độ biết trước (C ).
+Tiến hành phản ứng tương tự với một mẫu thử có nồng độ chưa biết (C ).
+Đọc mật độ quang của mẫu chuẩn (E ) và mẫu thử (E ).
+Tính nồng độ của chất cần phân tích trong mẫu thử dựa vào kết quả đo màu của dung dịch chuẩn và dung dịch thử. Nếu có pha loãng thì cần với độ pha loãng.
* EM = εlCM và ET = εlCT => EM /ET = CM /CT
CT = (ET /EM ) × CM hay CT = (ET /EM ) × CM× (độ pha loãng).
Liên hệ ngay để nhận được sự hỗ trợ tốt nhất:
Chúng tôi chuyên cung cấp các dịch vụ sửa chữa, lắp đặt, hướng dẫn sử dụng, bảo trì và bảo dưỡng các thiết bị y tế.